¿Por qué se unen los átomos?
Los átomos se unen porque, al estar unidos, adquieren una situación de mayor estabilidad que cuando estaban separados. En principio, podemos decir que existen dos maneras por las que un átomo puede adquirir estabilidad:
- Cuando existe transferencia de electrones entre átomos
- Cuando se comparten electrones entre átomos.
Los electrones que participan de las uniones químicas son los que se encuentran en el último nivel de energía. Por lo tanto:
El enlace químico (o unión química) puede entenderse por la presencia de una fuerza atractiva neta entre los átomos de los elementos que forman un compuesto. Esta atracción es de naturaleza electrostática, derivada de la Ley Básica de la Electrostática: las partículas con carga opuesta se atraen y las de igual signo se repelen. En la formación del enlace químico participan, por un lado, los núcleos atómicos, cargados positivamente y, por el otro, los electrones, con carga negativa. También pueden participar los iones. Esto dependerá del tipo de unión.
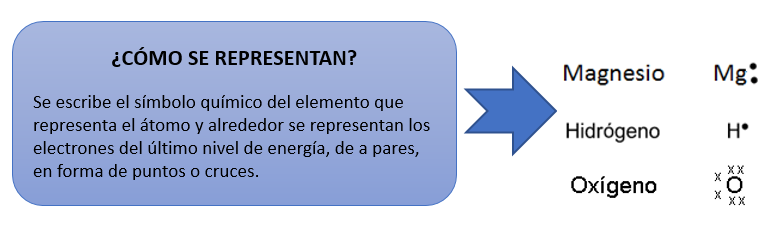
Es la representación con puntos o cruces de la cantidad de electrones
que posee un átomo en su último nivel de energía. Estas estructuras, al
ser parte de un modelo, no significa que sean una representación de lo que
sucede en la realidad, sino que son herramientas que nos serán de gran ayuda
para poder esquematizar las uniones químicas.

Regla del octeto
Como dijimos anteriormente, los átomos se unen porque, al estar unidos, adquieren una situación más estable que cuando estaban separados. Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel de energía es igual a ocho, estructura que coincide con la configuración electrónica externa de los gases nobles.
Los gases nobles tienen muy poca tendencia a formar compuestos y suelen encontrarse en la naturaleza como átomos aislados. Sus átomos, a excepción del helio, tienen 8 electrones en su último nivel. Esta configuración electrónica es extremadamente estable y a ella deben su poca reactividad. El helio también es un gas noble pero es el único de los gases nobles que posee solo 2 electrones externos aunque también se lo considera muy estable.
Podemos explicar la unión de los átomos para formar enlaces porque con ella consiguen que su último nivel tenga 8 electrones, la misma configuración electrónica que los gases nobles. Este principio recibe el nombre de regla del octeto y aunque no es general para todos los átomos, es útil en muchos casos.
La validez de esta regla no es universal porque existen excepciones (octeto incompleto u octeto expandido) que abordarás en Introducción a la Química, pero resultan ser una buena aproximación para explicar las uniones químicas.
