Masa atómica relativa (Ar) y masa molecular relativa (Mr)
Requisitos de finalización
Masa atómica relativa (Ar) Una vez definida la unidad de masa atómica, lo que se hizo fue comparar las masas de los distintos elementos con la unidad de masa atómica, para obtener una nueva escala de masas atómicas en "u". De esta manera, por ejemplo, un átomo del elemento Hidrógeno (H) tiene una masa 12 veces menor que la doceava parte de la masa de un átomo de C-12, mientras que un átomo del elemento oxígeno tiene una masa 15,9994 veces mayor que la doceava parte de la masa de un átomo de C-12.
![]()
Es importante que te acuerdes que la masa atómica relativa (Ar) NO lleva unidades. Sólo te dice cuántas unidades de masa atómica hay en un determinado elemento.
Ahora bien, ¿dónde encontramos el dato de la masa atómica? La respuesta es en la Tabla periódica, como se puede ver en la imagen correspondiente al elemento hidrógeno:
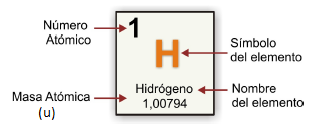
Pero... ¿por qué es un número decimal? Te invito a que prestes atención al siguiente video:
Cabe recordar que los ISÓTOPOS son partículas elementales que están formados por la misma cantidad de protones y diferente cantidad de neutrones, es decir, poseen el mismo número atómico (Z) y diferente número másico (A).
Masa molecular relativa (Mr)
Al igual que la masa atómica relativa (Ar), es un número sin unidades que indica cuántas unidades de masa atómica hay en una molécula. Se calcula sumando las Ar de los átomos que la forman. Para calcularla te invito a que veas el siguiente video:
Última modificación: martes, 25 de octubre de 2022, 18:07
