Estructura de la materia
Requisitos de finalización
¿Para qué se utilizan los modelos en química?
Para interpretar la Naturaleza, los científicos proponen representaciones lo más aproximadamente posibles a la realidad, que suelen denominarse Modelos.
Estos modelos se elaboran a partir de los resultados de la experimentación y su validez se prueba por medio de nuevos experimentos; si explican correctamente el comportamiento de la materia siguen en vigencia, de lo contrario son modificados o reemplazados por otros nuevos.
Por medio de los modelos se trata de explicar hechos o fenómenos que no se pueden observar directamente, tales como la estructura atómica, la naturaleza de la luz, etc.
Teoría atómico molecular
La historia de los modelos atómicos comienza varios siglos A.C., en la antigua Grecia. En ese entonces, eran los filósofos quienes, entre otras cosas, se ocupaban de pensar cómo estaba constituida la materia. Y había dos opiniones encontradas: por un lado, la de Demócrito y su maestro Leucipo, y por otro, la de Aristóteles.
Demócrito y Leucipo, sostenían que la materia estaba formada por diminutas partículas indivisibles, a las que denominaron “átomos”.
Aristóteles, por su parte, consideraba que la materia era continua y que los átomos no existían. Según él, cualquier cuerpo podía ser dividido indefinidamente, es decir, una vez roto en dos, los pedazos resultantes podrían ser fragmentados en otros de menor tamaño, y estos, de nuevo, podrían romperse y así sucesivamente, de forma que siempre es posible dividir cada uno de los trozos obtenidos.
Hoy sabemos que Demócrito y Leucipo tenían razón. Sin embargo, debieron transcurrir más de 2000 años para que la idea de los átomos fuera nuevamente considerada. John Dalton, Químico inglés, retomó la idea filosófica de Demócrito sobre la discontinuidad de la materia, y publicó en 1808 la primera teoría atómica con carácter científico, que se puede resumir en los siguientes postulados:
1) La materia está formada por partículas indivisibles, llamadas átomos, que no pueden crearse ni destruirse.
2) Todos los átomos de un mismo elemento son idénticos: tienen las mismas propiedades químicas e igual masa y tamaño y son diferentes a los átomos de cualquier otro elemento.
3) Los átomos de elementos distintos se combinan entre sí para formar compuestos.
4) Una reacción química sólo implica una redistribución de los átomos de los reactivos que se agrupan formando productos.
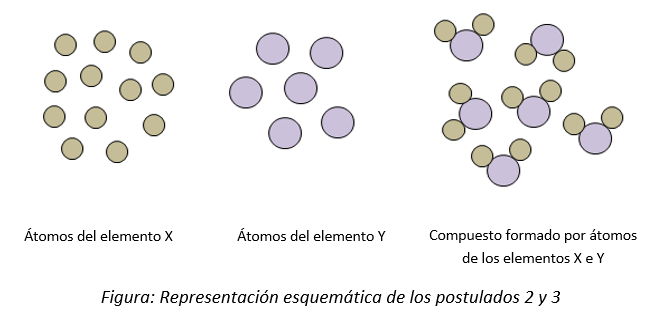
La estructura del átomo
Por medio de los modelos se trata de explicar hechos o fenómenos que no se pueden observar directamente, tales como la estructura atómica, la naturaleza de la luz, etc.

Dalton describió un átomo como una partícula extremadamente pequeña e indivisible. Sin embargo, una serie de investigaciones iniciadas alrededor de 1850, y que continuaron hasta el siglo XX, demostraron que los átomos están formados por partículas aún más pequeñas, denominadas partículas subatómicas. En el video que se encuentra a continuación, encontrarás una explicación de ello:
Aunque tienen la misma estructura general, los átomos no son todos iguales. Aquellos que tienen igual número de protones corresponden al mismo ELEMENTO QUÍMICO. El oxígeno, hidrógeno, carbono, sodio, cloro, etc. son algunos ejemplos. En la actualidad, existen alrededor de 118 elementos (que podrás encontrar en la Tabla Periódica y de cuyo estudio nos centraremos más adelante), de los cuales 92 se encuentran en la naturaleza, mientras que el resto se han creado en forma artificial en los laboratorios. Todos los elementos tienen un nombre específico. A veces, este nombre proviene de una palabra en latín o en griego, y puede hacer referencia a alguna propiedad del elemento, pero también pueden corresponder al nombre de un científico destacado, a un lugar o a algún personaje mitológico. El nombre del Hidrógeno tiene que ver con una propiedad: viene de los términos griegos hidro = agua y genos = que da origen, es decir, “el que da origen al agua”. El Cromo viene de la palabra griega chromos, que significa color y el selenio de Selene, la diosa griega de la Luna. El Einstenio lleva ese nombre en honor al físico Albert Einstein. Por el último, el Francio y el Germanio hacen alusión a dos países, Francia y Alemania, respectivamente.
Los nombres de los elementos se abrevian utilizando un SÍMBOLO QUÍMICO. El símbolo está relacionado con el nombre del elemento, y puede tener una, dos o tres letras; la primera siempre es mayúscula, y las siguientes son minúsculas; por ejemplo, el símbolo del cloro es Cl y el del carbono es C.
Los elementos químicos se representan en la tabla periódica de la siguiente forma:
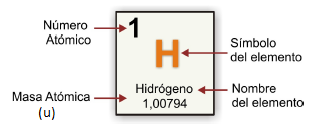
Cada elemento se caracteriza por tener un NÚMERO ATÓMICO, y como es único para cada átomo decimos que es la identidad del elemento.
Observa el siguiente video en el que podrás encontrar algunos conceptos importantes:
Otro tipo de partícula elemental son las MOLÉCULAS. En el siguiente video hablaremos un poco de ellas:
Ya hablamos de dos tipos de partículas elementales, los átomos y las moléculas, sin embargo existe un tercer tipo, los IONES. Los iones se forman cuando un átomo o un grupo de átomos ganan o pierden electrones. En estos casos, las cargas dejan de estar compensadas y estas partículas adquieren una carga eléctrica. Veamos esto con más detalle:
Apliquemos lo aprendido anteriormente, resolviendo un ejercicio:
Como pudiste ver en el ejercicio explicado en el video, el catión formado llamado "ion Magnesio" tendrá carga 2+ y se representará, Mg2+.
En química también nos podemos divertir, y más después de haber leído y visto todo este material 😊. Te propongo que utilices el programa cuyo link aparece abajo y construyas las siguientes partículas:
http://www.educaplus.org/game/constructor-de-atomos
- Elemento: Litio --> N°másico: 7; Carga: 0
- Elemento: Flúor --> N° másico: 19; Carga: 1-
- Elemento: Aluminio --> N°másico: 27; Carga: 3+
- Elemento: Argón--> N° másico: 40; Carga: 0
SUSTANCIAS SIMPLES Y COMPUESTAS
Ahora que presentamos el concepto de elemento, profundizaremos el concepto de sustancia. Como vimos en la Unidad anterior, una sustancia es una porción de materia constituida por partículas elementales idénticas. Todas las sustancias reciben un nombre específico y tienen una representación a partir de la simbología utilizada para los elementos.
La mayor parte de la materia está organizada en estructuras formadas por dos o más átomos que pueden ser del mismo elemento o de diferentes elementos.
Aquellas sustancias que estén formadas por partículas pertenecientes al mismo elemento, se denominan sustancias simples. Estas sustancias no se descomponen en otras más sencillas. De todas las sustancias simples conocidas, sólo los gases nobles se encuentran normalmente en la naturaleza como átomos aislados, por ejemplo, el argón (Ar). Otras, se presentan como moléculas diatómicas (formadas por dos átomos), como el oxígeno que respiramos cuya fórmula química es O2; y otras, como moléculas poliatómicas (formadas por tres o más átomos).
En la siguiente tabla, se presentan las sustancias simples más comunes ordenadas por su atomicidad (número de átomos por molécula):

Además de las sustancias simples existen las sustancias compuestas están formadas por partículas de distintos
elementos. Por ejemplo, el agua es una sustancia compuesta ya que cada
molécula de agua está formada por un átomo del elemento oxígeno
y dos átomos del elemento hidrógeno: H2O. Otros
ejemplos pueden ser: CO2 (dióxido de carbono) y CH4
(metano).
Estas
sustancias pueden descomponerse en otras más simples; por ejemplo, es posible
separar el hidrógeno y el oxígeno de la molécula de agua mediante un proceso denominado
“electrólisis”.


Última modificación: viernes, 21 de octubre de 2022, 12:35

